A veleszületett vérzékenységek közül a Haemophilia A-t a 8-as véralvadási faktor (FVIII), az 5-7-szer ritkábban előforduló Haemophilia B-t pedig a 9-es véralvadási faktor (FIX) hiánya, csökkent termelődése okozza. A haemophiliásoknál az elégtelen thrombinképződés vezet a fokozott vérzéshajlamhoz.
A betegek reziduális faktorszintjétől függően: súlyos és középsúlyos haemophiliákban gyakoriak a spontán vagy a normál terhelés melletti vérzések, de az enyhe formák esetén csak sérülés vagy műtétek, beavatkozások során jelentkeznek vérzések, amelyek akár súlyosak is lehetnek. A kétféle haemophilia tünetei teljesen megegyeznek: kezelés nélkül a vérzések min. 80%-a ízületi vagy izombevérzés. Az ismétlődő ízületi vérzések pedig hamar visszafordíthatatlan ízületi károsodásokhoz vezethetnek, melyek következménye a mozgásképesség romlása, krónikus fájdalmak, ízületi deformitások, csökkent munkaképesség és romló életminőség.
A haemophiliák kezelésének elsődleges célja tehát az ízületi és az életveszélyes vérzések megelőzése. Az elmúlt évtizedekben, a kezelés a hiányzó véralvadási faktor pótlását jelentette. A rendszeres, folyamatos faktorpótlás, a profilaxis minden életkorban jelentősen csökkenti a vérzésszámot, megelőzi vagy mérsékli az ízületi károsodások kialakulását. Bár egyre korszerűbb, plazma eredetű és rekombináns, ill. módosítások révén meghosszabbított féléletidejű faktorkoncentrátumok állnak már rendelkezésre, mégis a haemophiliák kezelése jelentős terhet jelent a betegek és családjaik számára a gyakori vénás injekciók adása, a vénázás nehézségei, a faktorpótlás mellett jelentkező áttöréses vérzések, és elsősorban a kisdedkorú betegeknél az inhibitor (faktor ellenes antitest) megjelenésének lehetősége miatt.
Az új fejlesztésű terápiák célja a még ritkább adagolás és/vagy a vénás beadási mód helyett egyszerűbb, például subcutan (bőr alá fecskendezett) adagolás lehetővé tétele, ill. a kezelésre használt, kívülről bevitt véralvadási faktorral szemben kialakult inhibitorral rendelkező betegek kezelési lehetőségeinek javítása. Az új terápiák egyúttal új megközelítési módot is jelentenek: már nem a faktor pótlása, hanem hiányzó működésének valamilyen módon történő utánzása vagy helyettesítése a célkitűzés.
A hemosztázist a véralvadást elősegítő procoagulánsok és az alvadást (thrombinképződést) gátló anticoagulánsok szigorúan szabályozott és érzékeny egyensúlya tartja fenn. Haemophiliák esetén a procoaguláns oldal „gyengül” a hiányzó alvadási faktorok miatt, így az egyensúly a vérzés, vérzékenység irányába billen el. Az új gondolatok egyike szerint a hiányzó faktort helyettesítsük valamivel, ami a véralvadási kaszkádot helyreállítva megfelelő thrombinképződéshez vezethet. A másik gondolkodásmód szerint pedig, ha a haemophiliákban a procoaguláns oldal gyengül, akkor gyengítsük az anticoaguláns oldalt is, egy új egyensúlyi állapotot létrehozva.
Tekintsük át az alábbiakban a jelenleg forgalomban lévő vagy a közeljövőben várhatóan elérhetővé váló (fázis 3 vizsgálatban lévő) nem faktorpótló terápiákat!
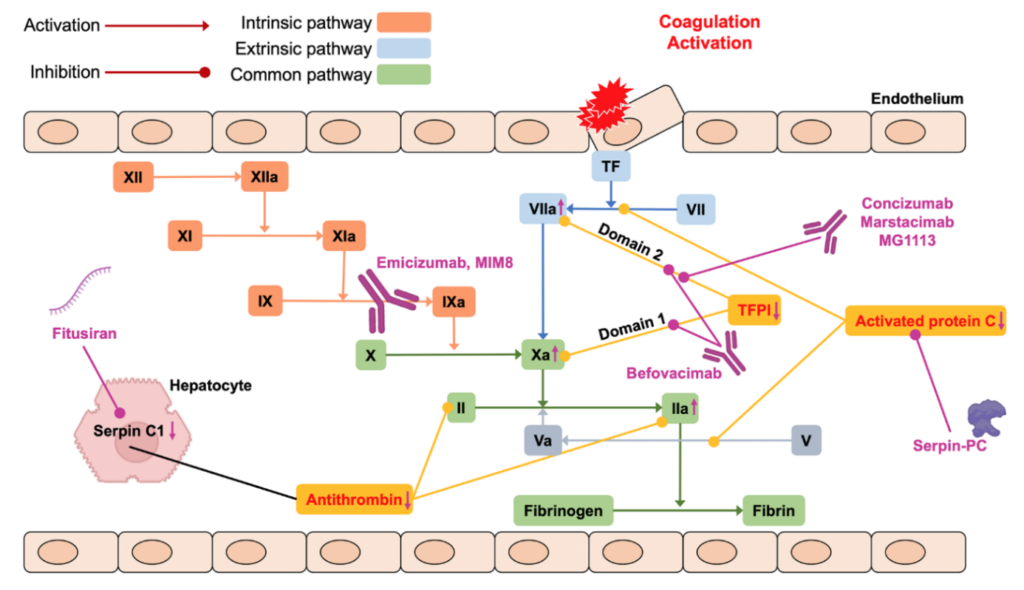
1.ábra: nem faktorpótló molekulák támadáspontja
I. Agonisták/mimetikumok: a véralvadási oldalt „erősítő”, faktorok hatását utánzó készítmények
1. Emicizumab
Jelenleg ez az egyetlen, klinikai vizsgálaton kívül elérhető, 2018 óta Magyarországon is használt nem faktorpótló készítmény. Humanizált, bispecifikus monoklonális antitest, mely révén egy nagyon szellemes ötlet vált hatékony gyógyszerré: a monoklonális antitest két „karja” közül az egyik az aktivált FIX-hez kapcsolódik, a másik a FX-hez, ezeket térben közelebb hozva egymáshoz, tulajdonképpen a FVIII molekula feladatát teljesíti, tehát haemophilia A-val élő betegeknek adható. Így létrejöhet a 10-es véralvadási faktor (FX) aktiválódása, melynek kulcsszerepe van a véralvadási kaszkádban, így a thrombinképződésben.
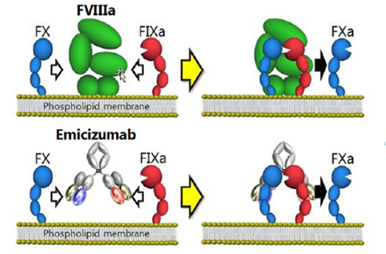
2.ábra: az emicizumab szerkezete, működése
A készítményt a bőr alá adott injekcióban (subcutan) kell adagolni. A 4 hetes telítés időszakában hetente (3 mg/kg), majd ezt követően a fenntartó kezelés idején adható hetente (1,5 mg/kg), 2 hetente (3 mg/kg) vagy 4 hetente (6 mg/kg) is. Elsősorban a szükséges dózis és a gyógyszer kiszerelése szabja meg az adagolási rendet, de a kezelőorvosok igyekeznek figyelembe venni a betegek preferenciáit is. Az emicizumabbal kapcsolatos klinikai vizsgálatokban (HAVEN 1-5) vizsgálták a molekula farmakokinetikáját is, s az eredmények felnőtteknél és gyermekeknél is igazolták, hogy a különböző adagolási módok egyenértékűek. Bármelyik alkalmazása esetén hasonló volt a gyógyszerszint, és alacsony a vérzésszám (ABR, annualized bleeding rate).
Az emicizumab, mivel szerkezetében semmi hasonlóságot nem mutat a 8-as véralvadási faktorral, hatását nem akadályozzák a FVIII-cal szemben képződött ellenanyagok (inhibitorok). Az emicizumab eredeti indikációs területe éppen ezért az inhibitoros haemophilia A volt, de a klinikai vizsgálatok eredményei alapján az indikációt kiterjesztették a nem inhibitoros haemophilia A betegekre is.
Magyarországon jelenleg inhibitoros haemophilia A betegek kaphatják a finanszírozó (NEAK) engedélyével, sikertelen, az inhibitor megszüntetését célzó immuntolerancia indukció kezelés (ITI) után. Van már példa néhány esetben kisgyermekeknél (PUP betegeknél) ITI közben adott emicizumab profilaxisra (egyedi méltányossági engedély alapján), melynek célja a vérzések megelőzése.
Hangsúlyozni szeretném, hogy az emicizumab folyamatosan aktivált állapotban tartja a véralvadási rendszert, egy adott hemosztatikus hatást tart fenn. Tehát profilaxisra alkalmas, nem vérzéskezelésre! Ha egy emicizumab profilaxison lévő betegnél vérzés jelentkezik, akkor annak csillapításához inhibitoros haemophilia A-ban bypass gyógyszer (elsősorban rFVIIa), nem inhibitoros betegnél pedig FVIII készítmény adására van szükség!
Az emicizumab a FX aktiválásán keresztül elméletileg, folyamatosan igen nagy mennyiségű thrombin képződéséhez vezethet, ezért vizsgálták a kezelés thrombogén kockázatát is. Ez minden korcsoportban nagyon alacsony volt. Néhány esetet leírtak, melyek nagyobb részben a kisebb erekben kialakult thrombosisok (thrombotikus microangiopathia) voltak, de mindegyiknél az egyik bypass készítményt, az aPCC-t nagy adagban és több napon át kapták a betegek. Ezért emicizumab adása mellett az aPCC profilaxist le kell állítani, vérzéscsillapításra elsősorban a másik bypass készítményt, a rFVIIa-t kell adni, szükség esetén az aPCC-t kis adagban, lehetőség szerint rövid ideig adható a thromboemboliás események kockázatának növekedése nélkül.
2. Mim8
A neve is mutatja, hogy ez is egy FVIII-mimetikum, mint az emicizumab. Egy újabb fejlesztésű bispecifikus antitest, amely jelenleg fázis 3 klinikai vizsgálatban (FRONTIER) van kipróbálva. Subcutan adható készítmény, inhibitoros vagy nem inhibitoros haemophilia A betegek részére, profilaxisra (a vérzések megelőzésére). Szerkezete hasonló az emicizumabéhoz, de még nagyobb mértékű (kb. 15-szörös) thrombinképződést vált ki.
Ennek ellenére nem jár magasabb thrombosis-kockázattal, mert tulajdonságai eltérőek: oldatban (a vérben keringve) csak kismértékben köti a FIXa-t és a FX-et, és aktiválja az alvadási rendszert, membránhoz kötődve viszont erős aktiválódást vált ki. Az is érdekes, hogy a Mim8 más helyen (más epitópon) kapcsolódik az aktivált IX-es faktorhoz, mint az emicizumab, így aMim8 a ritkán előforduló emicizumab ellenes antitestek jelenléte esetén is ki tudja fejteni vérzésmegelőző hatását (egyelőre csak kísérletek alapján, in vitro).
II. Antagonisták/rebalancing terápiák:a természetes anticoagulánsok kikapcsolása
Ismert, hogy még súlyos haemophilia esetén is, az azonos életkorú, azonos testsúlyú és hasonló aktivitású, a profilaxissal azonos völgyértékű betegek vérzésszáma nagyon különböző lehet. Évekkel korábban már vizsgálták, hogy mi lehet ennek az oka. Megállapították, hogy bármilyen súlyosságú (A vagy B) haemophilia enyhébb vérzéses fenotípusú lehet, ha a betegnek valamilyen társuló, veleszületett thrombosis hajlama, thrombophiliája van, mint például: heterozigóta Leiden mutáció, heterozigóta (enyhe) antithrombin-defektus (a normális 80-140% AT-szint helyett az érintett személynek 40-60% van).
1. Az antithrombin képződés gátlója: fitusiran
A legerősebb természetes anticoaguláns (a thrombinképződés legerősebb inhibitora) az antithrombin (AT), mely a májban termelődik. Gátolja a prothrombin-thrombin átalakulást, de a FXa-t és kismértékben a FIXa-t is. Az antithrombin tehát a véralvadás természetes gátló tényezője.
A fitusiran egy kis (rövid, small) RNS (nukleinsav), mely interferál az antithrombin-RNS-sel (azaz: siRNS), vagyis hasítja az antithrombin termelésért felelős mRNS-t, ezáltal csökkenti az antithrombin termelődését a májban. Így a hemosztázis új egyensúlya jön létre, vagyis egy véralvadást gátló tényező „gátlása” révén, a thrombinképződés, és következményesen a véralvadás fokozódását eredményezi. Mint a legtöbb nem faktorpótló kezelés, ez is subcutan adható készítmény.
A fitusiran hatásosságát és biztonságosságát, valamint a megfelelő és biztonságos dózist az ATLAS studykban vizsgálták, illetve a hosszútávú eredményekkel és a 12 éven aluli gyermekekkel kapcsolatos fázis 3 vizsgálatok még folyamatban vannak.
A fázis 1 vizsgálatban többféle, testsúlyra számított dózist kipróbáltak hetente, vagy havonta adva, illetve fix 80 mg-os dózist kaptak a betegek. A első időszakban 4 súlyos thrombosis fordult elő, ezért a vizsgálatot 2020 októberében szüneteltették, amíg ezeket az eseményeket részletesen megvizsgálták. Kiderült, hogy egyes betegek antithrombin szintje túlzottan alacsonyra csökkent (10% körüli vagy alatti értékre), ill. vérzéskezelésre több beteg is a szokásos, nagy dózisban kapott FVIII kezelést.
Ezután folytatódtak a klinikai vizsgálatok, bizonyos intézkedésekkel, a nagyobb biztonság érdekében:
– bevonás előtt thrombophilia vizsgálatot végeztek a betegeknél (Leiden, Prothrombin G20210A mutáció, AT-szint) – csak olyan betegeket vontak be, akiknek az alap AT-szintje 60% feletti volt, ill. nem volt társuló thrombophiliájuk (fokozott veleszületett thrombosis rizikó)
– kizárták azokat, akiknek anamnézisében volt thromboemboliás (TE) eseményük, infarktusuk, anginájuk, szívbillentyű betegségük, pitvarfibrillációjuk (fokozott szerzett thrombosis rizikó)
– magasabb cél antithrombin értéket tűztek ki, és kisebb kezdő fitusiran dózist (50 mg) adva, gyakori AT-szint ellenőrzés mellett, óvatosan emelték vagy éppen csökkentették a gyógyszer adagját, ill. egyeseknek csak 2 havonta adták (személyre szabott dozírozás)
– vérzéskezelésre a szokásosnál kisebb dózisú faktorpótlást ajánlottak: haemophilia A-ban 10-20 E/kg FVIII, haemophilia B-ben 20-30 E/kg FIX; inhibitoros betegeknek alacsonyabb dózisú bypass kezelést: aPCC 30-50 E/kg, rFVIIa <45 ug/kg
Mindezek után nem volt a gyógyszernek tulajdonítható TE esemény, más súlyos mellékhatás, csak enyhe adverz események fordultak elő (a betegek kb. 13%-nál): mérsékelt májenzim emelkedés, epekövesség, epehólyag gyulladás. Viszont a fitusiran profilaxist kapó betegek vérzésszáma jelentősen csökkent, a betegek 50,6%-a vérzésmentes volt a vizsgálat ideje alatt.
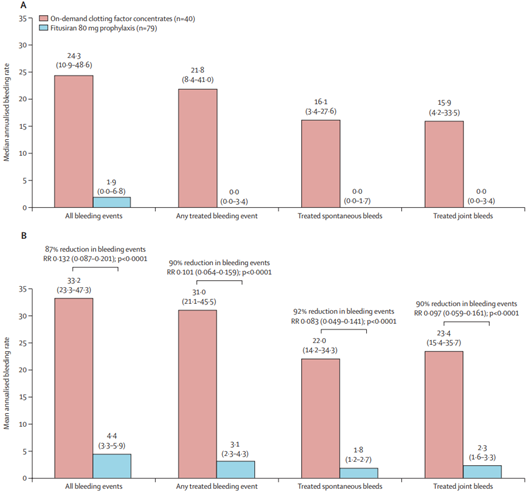
3.ábra: a fitusiran hatása a betegek vérzésszámára
A fitusiran profilaxis, a hatásmechanizmusának megfelelően az első olyan kezelés, mely haemophilia A és B betegeknél is hemosztatikus hatású, függetlenül az inhibitor jelenlététől. Ezért ha a klinikai vizsgálatok lezárulása után forgalombahozatali engedélyt kap, gyökeresen átalakíthatja a haemophiliák kezelését.
2. anti-TFPI: concizumab,marstacimab
A TFPI a szöveti faktor (TF) által meghatározott útvonal, vagyis az extrinsic véralvadási út (és ezen belül a FXa, és ahhoz kapcsolódan aTF–FVIIa komplex) gátlója, természetes inhibitora, ezáltal fontos szerepet játszik a szöveti sérülés utáni kezdeti thrombinképződés szabályozásában.A TFPI különböző részei (doménjei) a véralvadás más-más fontos tényezőjéhez kapcsolódnak. A domén-1 a szöveti faktor-FVIIa komplexhez, a domén-2 az aktivált 10-es véralvadási faktorhoz (FXa) és a domén-3 a Protein A-hoz tud kötődni, s így gátló hatást kifejteni.
A concizumab egy humanizált monoklonális antitest, melyet a TFPI 2-es doménjével szemben terveztek, így elsősorban az FXa aktív régióján keresztül gátolja a TFPI aktivitását, ezáltal serkenti a véralvadást (fokozza a thrombinképződést). A specifikus antitest hatásosságát és biztonságosságát, ill. a beadási módot (vénás vagy subcutan) az Explorer vizsgálatokban kutatták.Megállapították, hogy a concizumab dózisfüggően fokozta a thrombinképződést, és subcutan is jól adható készítmény. Viszont előfordultak thrombosisos szövődmények: szívinfarktus, veseinfarktus, mélyvénás és felületes vénás thrombosis, ami miatt a vizsgálatot felfüggesztették, majd a protokoll módosítása után, csökkentett dózis alkalmazásával folytatták. A fázis 3 vizsgálat még jelenleg is folyamatban van.
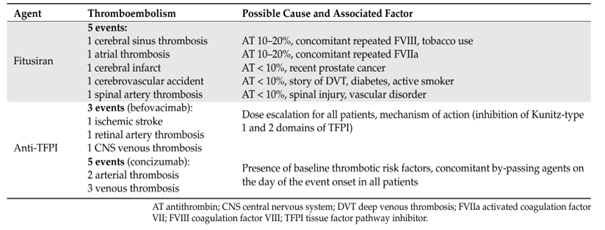
4.ábra: thromboemboliás mellékhatások a rebalancing terápiák klinikai vizsgálata során
A concizumab is alkalmas inhibitoros és nem inhibitoros, haemophilia A-val és B-vel élő betegek kezelésére egyaránt. Féléletideje jelentősen rövidebb, mint a fitusirané, a concizumab naponta történő adása javasolt a megfelelő hatás fenntartásához.
Egy másik anti-TFPI monoclonalis antitest a marstacimab, amely szintén a 2-es doménhoz kötődik specifikusan, subcutan adható, és ezzel a készítménnyel is folyamatban van a fázis 3 vizsgálat.
A nem faktorpótló terápiák területén még több más készítménnyel zajlanak fázis 1 és fázis 2 vizsgálatok, ezek is még újabb kedvező eredményekkel kecsegtetnek. Látható, hogy az utóbbi évtizedben forradalmi változások kezdődtek a haemophiliák kezelésében, melyek teljesen átalakíthatják a korábbi szemléletünket.
Irodalom:
1. Batorova, Boban et al.: Expert opinion on current and future prophylaxis therapies aimed at improving protection for people with hemophilia A (Journal of Medicine and Life, Vol 15, Issue 4 April,2022)
2. Hartmann J, Croteau SE. 2017 Clinical trials update: Innovations in haemophilia therapy (A J Hemat. 2016;91(12):1252–1260)
3. Sampei Z, Igawa T, et al.: Identification and Multidimensional Optimization of an Asymmetric Bispecific IgG Antibody Mimicking the Function of Factor VIII Cofactor Activity (PLoS One. 2013;8(2):e57479. – open access, freely available online)
4. Klamroth R.: A new era of treatment for patients with haemophilia A? (Hamostaseologie. 2017;37(3):216–218.)
5. Zombori M.: Paradigmavátás a haemophilia terápiájában a XXI. században (Gyermekgyógyászati Továbbképző Szemle, XXIV. évf. 5.)
6. Hartmann, Croteau: 2017 Clinical trials update: Innovations in hemophilia therapy (American Journal of Hematology, Vol.91 No12, December 2016)
7. Gualtierotti, Pasca, Peyvandi et al.: Updates on Novel Non-Replacement Drugs for Hemophilia (Pharmaceuticals 2022,15,1183., https://doi.org/10.3390/ph15101183)
8. Sara Boyce, Savita Rangarajan: RNAi for the Treatment of People with Hemophilia: Current Evidence and Patient Selection (Journal of Blood Medicine 2023:14 317–327)
9. L. Luo, Q. Zheng, Z. Chen et al.: Haemophilia A patients with inhibitors: Mechanistic insights and novel therapeutic implications (Frontiers in Immunology, DOI: 10.3389/fimmu.2022.1019275)
10. Srivastava, Rangarajan: Fitusiran prophylaxis in people with severe haemophilia A or haemophilia B without inhibitors (ATLAS-A/B): a multicentre, open-label, randomised, phase 3 trial (Lancet Haematol 2023; 10: e322–32)